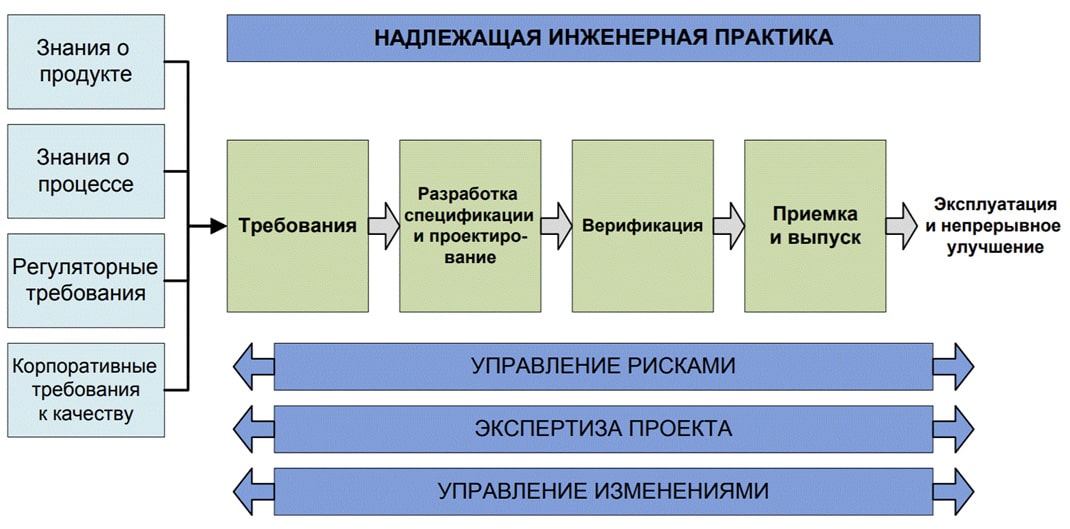
Резидент «Экобалтика» компания «Инфамед», представляющае самое западное фармпроизводство в России, выступила партнёром предконференционного дня I Ежегодной конференции ISPE ЕАЭС. В своём выступлении член совета директоров компании Евгений Горохов сравнил подходы к проектированию в России и странах ЕС на стадии квалификации проекта (DQ).
- При планировании инвестором новых фармацевтических объектов – как производственных, так и логистических – нужно исходить из целеполагания: где находятся ваши рынки сбыта, какова производственная программа. С самого начала необходимо выбирать консультантов и представителей регуляторов из регионов вашего присутствия. Они должны помогать инвестору писать URS и делать DQ проекта или стадии «П». Важный этап – это design review или проверка проекта, в ходе которой он оценивается в соответствии с требованиями того или иного регулятора. Вам следует проверить результаты своих предыдущих действий и выявить вероятные проблемы, прежде чем переходить к следующему этапу работ –заказывать основное технологическое оборудование и т.д.
Если речь идет о выборе рынков нескольких стран, например, в рамках ЕС, СНГ или ЕАЭС, производство должно одновременно соответствовать многим стандартам, как по инженерной составляющей (GxP, FDA и проч.), так и по производственной (GMP РФ, cGMP, FDA). Обеспечить соответствие стандартам, принятым сразу на всех таких макро-рынках, достаточно дорогое удовольствие, так что уже при эскизном проектировании будущего объекта инвестор должен выбирать некий компромисс, основываясь на рациональности, тщательно взвешивая все «за» и «против» того или иного решения.
Поэтому в начале проектирования не стоит экономить на DQ или DR своего проекта при участии иностранных специалистов. Их грамотные решения в дальнейшем дадут возможность работать в более обширных регионах сбыта.
В итоге готовый объект должен отвечать регуляторным требованиям тех регионов, на которых предполагается регистрация и продажи вашей продукции. Что касается управления системами качества, соответствовать многим из указанных выше стандартов не так уж сложно. Достаточно лишь вести свою систему управления качеством на двух языках и с определенной периодичностью проводить тренировочные аудиты и САРА с участием инспекторов из интересующих вас иностранных юрисдикций.
Сравнивая подходы к проектированию в России и странах ЕС, можно отметить следующее. Как правило, в нашей стране после формирования технического задания все сразу приступают к проектированию (проект, РД) и строительству, а уже затем начинают думать о ВМП, валидации и прочих вещах. URS возникает обычно уже после, что, безусловно, запоздало и неверно.
Классический же подход к проектированию в ЕС – это написание URS заранее. Мы в «Инфамеде» руководствуемся этим принципом. Так, например, для строительства склада стандарта GDP в индустриальном парке «Экобалтик» URS был подготовлен при участии не только российских, но и европейских специалистов. Это дало возможность учесть все заложенные в нормативах требования, сравнивать лучшие практики РФ и ЕС еще до стадии планировки и, соответственно, применить их. В результате URS для этого объекта содержит примерно на 45% больше информации, чем стандартное техзадание, которое обычно формируется при строительстве подобного объекта в России. Поэтому общая рекомендация - обязательно делать URS заранее!
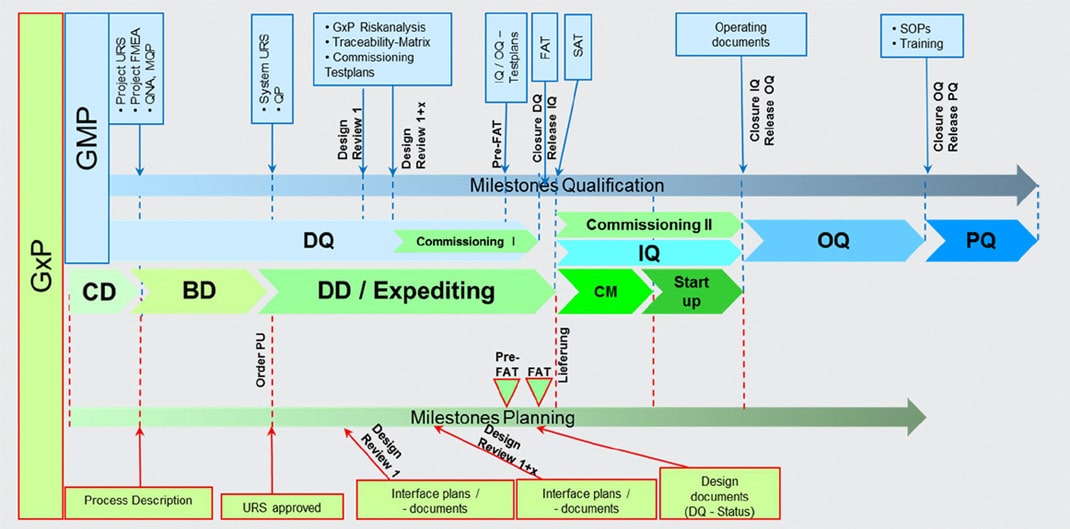
В 2019 году при вводе в эксплуатацию цеха производства субстанций (АФИ) завода «ИНФАМЕД К» благодаря проведенному европейскому DQ проекта было выявлено 14 критических и 86 существенных замечаний. Среди них:
Все замечания были учтены на этапе «П», а затем требования внедрили на производстве АФИ, функционирующем сегодня. Это сегодня позволяет достаточно легко проходить все инспекции из Европы.
В то же время если инвестор планирует сбыт своей продукции на европейских рынках, ему необходимо учесть, что в ЕС существует несколько «регуляторных школ». Одна из главных – «немецко-говорящая» группа, которая продвигает свою трактовку отдельных норм. Кроме неё есть группы «южно-европейская», «восточно-европейская» и др. Поэтому очень важно учитывать рекомендации региональных регуляторов и консультантов еще при создании URS. Что касается будущей эксплуатации объекта, а также будущей готовности системы качества, здесь всё не так сложно. Самое главное – вовремя и на регулярной основе организовывать обмен опытом.
Например, на завод «Инфамед К» в среднем каждые 9 месяцев приезжают аудиторы из Австрии. Раз в год специалисты AGES (австрийский аналог Минздрава, Минпрома, Росздравнадзора и проч.) проводят тренировочные аудиты на соответствие GMP. Практически 60% документации системы качества ведется в двуязычном формате. Поэтому завод готов к визиту официального инспектората, когда будет подавать заявку на импортную производственную лицензию для стран ЕС.
Анализ изменений регуляторики на разных рынках последних лет показывает, что гармонизация норм различных юрисдикций в дальнейшем неизбежна. Это облегчит инжиниринг и регулирование в процессе деятельности. Но сегодня, к сожалению, такой гармонизации нет. Поэтому инвестору, планирующему строительство фармацевтического завода, необходимо определиться с рынками сбыта и постараться максимально предусмотреть соответствие нормам (в том числе GxP) и регуляторике тех регионов, в которые планируются поставки продукции. Исходя из этого, следует собирать качественную инжиниринговую команду, которая будет помогать инвестору. Один лишь бизнес-план или только производственная программа не способны учесть все тонкости и ответить на все вопросы.
Специалисты компании «Инфамед» готовы поделиться своим опытом по этой и другим темам с участниками фармацевтического рынка.
Евгений Горохов – член совета директоров компании «ИНФАМЕД»